
아이맘 문의전화
365일연중무휴/야간진료실시
- 평일|
- 오전 08시 - 오후 09시
- 토/일/공휴일|
- 오전 09시 - 오후 06시
예방접종
| 제목 | 로타바이러스 예방접종 | 조회수 | 2316 |
|---|---|---|---|
|
로타바이러스(Rotavirus) 1. 원인 병원체 로타바이러스(Rotavirus)  2. 임상양상 ◦ 무증상, 가벼운 수양성 설사 또는 고열과 구토를 동반한 심한 설사 ◦ 합병증 : 탈수, 전해질 불균형, 대사성 산증 3. 진단 ◦ 임상적인 경과로 진단 ◦ 효소면역분석법(enzyme immunoassay)으로 로타바이러스 항원 검출 ◦ 기타 분자생물학적 진단 4. 치료 ◦ 보존적 치료 5. 예방접종 [접종대상 및 시기] ◦ 5가 백신 : 2, 4, 6개월 ◦ 1가 백신 : 2, 4개월 - 1차 접종은 생후 6주부터 시작할 수 있으며, 14주 6일까지 1차 접종시작 가능 - 접종 간 최소 간격은 4주 - 8개월 0일까지 접종을 완료 [접종용량 및 방법] ◦ 5가 백신 : 2 mL 경구 투여 ◦ 1가 백신 : 동결 건조 백신을 같이 제공된 1 mL의 용매에 녹여 경구 투여 [이상반응] ◦ 발열, 설사, 구토, 혈변 등 경미함 ◦ 허가 전 임상연구에서 장겹침증과 발생이 무관해 보이나 향후 허가 후 자료가 더 필요함 [금기사항] ◦ 백신 성분에 심한 알레르기 반응 ◦ 라텍스 알레르기(1가 백신) ◦ 중증 복합면역결핍증 [주의사항] ◦ 급성 위장염 ◦ 중증 질환 ◦ 기존의 만성 위장관 질환 ◦ 장겹침증 자주 묻는 질문(FAQ) 1. [백신] 우리나라에서 사용 가능한 로타바이러스 백신은 어떤 것이 있나요? 국내에는 현재 두 가지 종류의 백신이 있고 5가 백신인 로타텍과 1가 백신인 로타릭스가 있습니다. 두 가지 백신 모두 경구 투여합니다. 2. [접종시기] 로타바이러스 백신을 접종 받아야 하는 연령은 어떻게 되나요? 5가 백신인 로타텍은 각각 생후 2, 4, 6개월에 한 번씩 세 번을 접종하고, 1가 백신인 로타릭스는 생후 2, 4개월에 한 번씩 두 번을 접종합니다. 두 가지 백신 모두 1차 접종 시작은 최소연령은 6주이고 최대연령은 14주 6일까지입니다. 최소 접종간격은 4주이고 마지막 접종가능연령은 8개월 0일입니다. 3. [백신 효과] 로타바이러스 백신은 질병 예방효과가 얼마나 좋은가요? 효능 연구에 의하면, 백신 접종 후 1년 내에 발생하는 심한 로타바이러스 질환에 대해서는 85~98% 방어력이 있고, 심한 정도와 관계없이 모든 로타바이러스 질환에 대해서는 74~87%가 예방효과가 있습니다. 4. [동시접종] 로타바이러스 백신은 다른 백신과 동시에 접종할 수 있나요? 로타바이러스 백신은 DTaP, Hib, IPV, B형간염, 단백결합 폐렴구균 백신과 같이 접종할 수 있습니다. 로타바이러스 백신은 이들 백신의 면역반응을 방해하지 않는 것으로 알려져 있습니다. 5. [백신] 로타바이러스 백신은 수은이나 티메로살을 포함하고 있나요? 로타바이러스 백신은 티메로살이나 다른 보존제를 포함하고 있지 않습니다. 6. [금기사항] 미숙아에게도 백신을 접종할 수 있나요? 가족 중에 면역저하자나 임신부가 있는 경우 백신을 접종해도 되나요? 백신을 접종받을 영아가 미숙아로 출생한 경우나 가족 중에 면역저하자 또는 임신부가 있는 경우에도 백신접종의 금기사항은 아니며 접종 할 수 있습니다. 예방접종에 대한 상세 설명(참고) 1. 개요 인류에게 설사질환은 이미 고대부터 알려져 왔다. 1970년대 초기까지는 세균, 바이러스 또는 기생충 등의 병원체가 전체 소아 설사질환의 30% 미만에서만 확인될 수 있었다. 1973년에는 비숍 등이 설사하는 소아의 장조직에서 전자현미경으로 바이러스 입자를 관찰하였다. 이 바이러스는 바퀴를 닮은 모습으로 인해 이후 “로타바이러스”라 명명되었다(rota는 바퀴를 의미하는 라틴어). 1980년에 이르러서 로타바이러스가 미국에서 영아와 어린 소아에서의 심한 위장관염의 가장 흔한 원인으로 알려지게 되었다. 현재 로타바이러스 감염은 5세까지의 거의 모든 소아들이 감염될 정도로 흔하다는 것이 알려져있다. 로타바이러스는 미국에서 연간 20~60명의 사망자와 전세계적으로 약 500,000명에 이르는 설사 관련 사망의 원인으로 알려져 있다. 로타바이러스 감염을 예방하기 위한 백신은 1998년에 처음으로 허가를 받았으나 장겹침증 발생과의 연관성으로 인해 1999년에 취소되었다. 새로 나온 백신들이 미국에서 2006년과 2008년에 허가되었으며, 우리나라에서는 2007년과 2008년에 허가되었다. 2. 로타바이러스(Rotavirus) 로타바이러스는 Reoviridae 과에 속하는 이중 가닥 RNA 바이러스이다. 바이러스는 11개의 유전자 조각과 이를 둘러싸고 있는 세 층의 동심성 외피로 구성되어 있다. 가장 바깥층의 외피에는 중요한 단백인 VP7(G 단백)과 VP4(P 단백)가 포함되어 있다. VP7과 VP4가 바이러스의 혈청형을 결정하고 방어면역에 관련될 것으로 추측되는 중화항체를 유도한다. 로타바이러스는 매우 안정하여 환경에서 수주에서 수개월동안 생존할 수 있다. 로타바이러스는 소와 원숭이를 포함한 여러 포유류에서 감염을 일으킨다. 이러한 동물 바이러스주들은 사람 감염을 일으키는 바이러스주들과는 항원성이 다르며 사람 감염을 일으키는 경우는 드물다. 3. 발병기전 바이러스는 입을 통해 몸속에 들어오며 소장의 융모상피에서 증식한다. 면역이 정상인 사람에서는 소장 이외의 장소에서 바이러스가 증식하거나 바이러스 혈증을 일으키는 것은 드문 것으로 알려져있다. 이 바이러스에 감염되면 장에서의 나트륨, 당, 수분 등의 흡수가 감소하고 장의 lactase, alkaline phosphatase, sucrose의 활동이 감소되어 등장성 설사를 유발할 수 있다. 로타바이러스 감염의 예방과 관련된 면역학적 지표는 잘 알려져 있지 않다. VP7과 VP4에 대한 혈청과 점막의 항체가 질병의 예방에 중요할 것으로 추측된다. 세포매개 면역이 감염으로부터의 회복과 예방에 일정한 역할을 할 것으로 여겨지고 있다. 첫 번째 로타바이러스 감염으로부터 회복되어도 영구 면역이 생성되지는 않는다. 한번 자연감염된 후에는 38%의 소아에서 감염 자체에 대해, 77%는 로타바이러스 설사에 대해, 그리고 87%는 중증설사에 대해 예방효과가 있다. 재감염은 어느 연령에서나 일어날 수 있으며, 이후의 감염은 점점 더 예방력을 유발하며 일반적으로 첫 감염 보다 중증도가 낮다. 모든 연령에서 반복적인 감염이 일어날 수 있으며 대개 증상이 없거나 구토와 미열을 동반하는 가벼운 설사를 유발한다. 4. 임상양상 로타바이러스에 의한 설사의 잠복기는 짧아서 대부분 48시간 이하이다. 감염의 임상양상은 초감염인지 재감염인지에 따라 다르다. 생후 3개월 후의 초감염이 일반적으로 가장 심한 경과를 나타낸다. 감염되어도 증상이 없을 수 있으며, 가벼운 설사가 발생하거나 고열과 구토를 동반한 심한 탈수를 유발할 정도의 심한 설사도 초래할 수 있다. 약 3분의 1까지의 소아에서 39°C 이상의 고열이 발생할 수 있고 위장관 증상은 대부분 3일에서 7일 내에 회복된다. 로타바이러스 감염에 의한 설사질환에서 임상양상과 대변의 양상은 비특이적이고 비슷한 질병양상이 다른 병원체에 의하여 발생할 수 있다. 그러므로 로타바이러스에 의한 설사질환의 확진을 위해서는 실험실적 검사가 필요하다. 로타바이러스 감염의 합병증으로 영아나 어린 소아에서 심한 설사, 탈수, 전해질 불균형, 대사성 산증 등이 발생할 수 있다. 선천성 면역결핍, 조혈모세포 이식, 장기 이식 등으로 인해 면역기능이 저하된 소아들은 심하거나 장기간 지속되는 위장관염을 앓을 수 있으며, 여러 장기(특히 신장, 간)에 이상이 나타날 수 있다. 5. 진단 가장 보편적인 확진 방법은 효소면역분석법(enzyme immunoassay, EIA)으로 대변에서 로타바이러스 항원을 검출하는 것이다. 사람 로타바이러스에 공통적인 항원을 검출하는 상용화된 여러가지 Kit들이 개발되어 있으며 이들은 사용하기 간단하고, 저렴하며 민감도가 높다. 다른 검사법들(전자현미경,역전사중합효소연쇄반응, 핵산교잡법, 염기서열 분석, 배양)은 주로 연구용으로 사용된다. 로타바이러스 항원은 질병 발생 후 3~7일째에 환자의 혈청에서 검출된 적도 있으나 현재 진단을 위한 검사는 일차적으로 대변에서 시행한다. 6. 치료 특별한 항바이러스제 치료법은 없다. 설사나 구토, 발열로 인해 탈수나 전해질의 불균형이 문제가 될 수 있으므로 수액 보충이나 산-염기 불균형을 교정하는 등 환자 상태에 따라 대증요법으로 치료한다. 7. 역학 로타바이러스 감염은 전세계적으로 발생한다. 특정 로타바이러스 주에 의한 감염 발생은 지역에 따라 다르며 백신에 포함되지 않은 바이러스 주가 유행하는 곳도 있다. 병원소는 사람의 위장관과 감염된 사람의 대변이다. 로타바이러스 감염은 사람 이외의 다른 포유류에도 발생하지만 동물의 로타바이러스가 사람에게 전파되는 것은 매우 드물고 임상적인 질병으로까지 진행하지는 않을 것으로 추정된다. 면역저하자가 로타바이러스 배출을 장기간 지속할 수는 있겠으나 확실한 보균상태는 기술된 바 없다. 로타바이러스는 감염된 사람의 대변에 높은 농도로 배출된다. 전파는 사람간의 긴밀한 접촉과 분비물로 오염된 물건(대변으로 오염된 장난감과 환경의 표면)등에 의한 대변-구강 경로로 이루어진다. 이외에 로타바이러스는 대변으로 오염된 음식, 물과 호흡기 비말 등의 다른 경로로도 전파될 것으로 추정된다. 로타바이러스 감염은 온대기후에서 주로 가을과 겨울에 발생한다. 국내에서도 추운 계절에 주로 발생한다. 이러한 계절성의 원인은 알려져 있지 않다. 열대기후에서는 온대기후보다 계절성을 덜 보인다. 로타바이러스는 매우 전염성이 높아서 5세가 될 때까지 거의 모든 소아들이 감염된다. 감염된 사람은 설사가 시작되기 2일 전부터 증상 발생 10일까지도 많은 양의 바이러스를 대변에 배출한다. 로타바이러스는 면역저하자의 대변에서는 감염 30일 이후까지도 검출될 수 있다. 가족 내, 시설 내, 병원 내 그리고 어린이 보육 시설에서의 전파가 흔하다. 가. 국외 2001년부터 전세계 59개 국가의 196개 감시 사이트에서 로타바이러스 감염 감시사업을 시행하여 왔으며 질병 부담과 유행하는 로타바이러스주에 대한 정보가 축적되었다. 지역마다 차이는 있었으나 로타바이러스가 심한 설사의 주요 원인인 것은 일관적으로 관찰되었다. 5세 미만의 소아에서 심한 설사로 입원한 경우 로타바이러스 양성으로 진단된 경우가 중앙값 39%로 관찰되었다(국가마다 20~73%로 차이가 있음). 이는 병원에 입원한 소아들을 대상으로 한 감시사업으로서, 전세계 로타바이러스 감염과 관련된 사망은 연간 527,000명이었다. 미국에서 1996년에서 2005년까지 검출된 바이러스의 G 또는 P형의 85% 이상이 현재 사용되는 5가 로타바이러스 백신에 포함되는 것으로 보고되었다. 실제로 세계적으로 가장 흔하게 유행하는 것은 G1-G4, G9형과 P[8]형이다. 그러나, 유행하는 로타바이러스의 혈청형은 해마다 지역, 나라마다 다른것이 보고되고 있다. 또한 이들 바이러스주들의 변화가 로타바이러스 백신의 효과에 어떤 영향을 줄지도 중요하다. 나. 국내 국내에서 로타바이러스 감염은 법정 감염병은 아니다. 그러므로 로타바이러스 발생과 질병 부담을 특정 조사나 코호트 연구, 병원 퇴원자료 등으로 추정할 수 밖에 없다. 또한, 질병관리본부에서는 2005년부터 전국 16개 시·도 보건환경연구원을 중심으로 관내 1, 2차 의료기관과 연계하여 급성설사 질환 실험실 감시사업을 운영하고 있다. 본 사업을 통해 설사와 함께 복통 및 구토 등의 증상으로 지역 의료기관에 내원 및 입원한 환자들을 대상으로 장염 바이러스 4종(A형 로타바이러스, 노로바이러스, 장아데노바이러스, 아스트로바이러스)에 대한 실험실 진단을 수행하여 매주 바이러스 발생정보를 질병관리본부의 병원체 실험실 감시정보 웹사이트에서 제공하고 있다. 1980년부터 1999년까지 20년 동안 급성 설사로 입원한 4,668명의 소아환자를 대상으로 한 연구에서 로타바이러스는 급성 설사 원인의 46%로 나타났다. 같은 연구에서 로타바이러스 유행시기에는 수양성 설사로 입원한 60% 이상의 환자가 로타바이러스 감염에 의한 것이었다. 1980년대와 1990년대 초기까지의 연구들에서 로타바이러스에 의한 급성 위장관염의 연령별 분포를 보면 6~24개월까지의 소아가 84%로 가장 많고 6개월 미만의 영아는 10%, 24개월이 지난 소아는 6%로 보고되었다. 바이러스의 혈청형 또는 유전형의 분포는 지속적인 변화가 있다. 효소결합면역흡착검사법(ELISA)을 시행한 1987~1989년에는 G1 혈청형이 45%로 가장 많았고, 1998~1999년에는 G4 혈청형 58%, G1 혈청형 24%, G2 혈청형 13%의 순이었다. 국내에 로타바이러스 백신이 도입되기 직전인 2005년 4월부터 2007년 3월까지 전국 8개 병원에서 수집된 1,299개의 로타바이러스 양성 검체에서 시행한 연구에서는 G1P[8]가 36%로 가장 흔하였고 G3[P8] 16%, G4P[6] 8.9%, G1P[6] 8.2% 순으로 검출 되었다. 로타바이러스 백신이 도입되고 있던 시기인 2007~2009년에 시행된 서울의 한 대학병원에서 검출된 580개의 로타바이러스 검체를 이용한 연구에서는 G9P[8]가 33.8%, G1P[8] 30.9%, G3P[8] 12.2%의 순으로 검출되었다. 로타바이러스 감염 위험이 높은 사람들은 바이러스에 노출될 위험이 높은 경우로 어린이집 출석,병원에 입원한 소아(병원 감염), 어린이집이나 병원에서 소아를 돌보는 성인이나 부모, 면역저하 상태의 소아 및 성인들이다(예, 중증복합면역결핍증, HIV 감염, 조혈모세포이식). 8. 예방 가. 환자 및 접촉자 관리 주된 감염경로는 대변-구강이며 표준 주의와 함께 가능한 접촉 주의를 준수한다. 나. 예방접종 1) 백신 (가) 역사 처음 개발된 로타바이러스 백신들은 소나 원숭이에서 분리된 바이러스로 만들어졌다. 몇몇 연구에서 이들 경구용 생백신이 어린 소아에서 로타바이러스 설사를 예방할 수 있음을 보여주었으나 그 효능이 매우 다양하였다. G(VP7) 또는 P(VP4) 단백에 대한 면역이 질병예방과 회복에 연관이되기 때문에 새로운 생백신도 주로 유행하는 혈청형의 G 단백 단독 또는 G와 P 단백 모두를 포함하여 개발되었다. 1998년에 rhesus 원숭이에서 유래된 4가 로타바이러스 백신(Rotashield, 로타실드, RRV-TV, rhesus based vaccine-Tetravalent rotavirus vaccine)이 미국에서 허가받아 영아를 대상으로 기본접종으로 권장되었다. 그러나 RRV-TV는 도입된지 1년 안에 장겹침증과의 연관성 때문에 허가가 취소되었다. 장겹침증의 위험은 RRV-TV 첫번째 접종 후 3일에서 14일 내에 가장 높았으며(20배 이상 증가), 두번째 접종 후 3일에서 14일 이내의 위험은 이보다 낮았다(약 5배). 전체적으로 RRV-TV 첫번째 접종 후 이와 연관된 위험은 약 10,000명의 백신 피접종자 당 1건으로 추정되었다. 일부 연구자들은 RRV-TV와 연관된 장겹침증이 연령과 관계가 있을 수 있음을 제시하였고, 장겹침증 발생의 절대 발생건수와 아마도 첫번째 접종된 RRV-TV와 장경침증의 발생에 대한 상대위험이 백신 접종 당시의 나이가 많을수록 높을 수 있음을 제시하였다. (나) 백신종류 및 국내 유통백신 현재 한국에서 허가된 로타바이러스 백신은 두 가지가 있다(표 21-1). 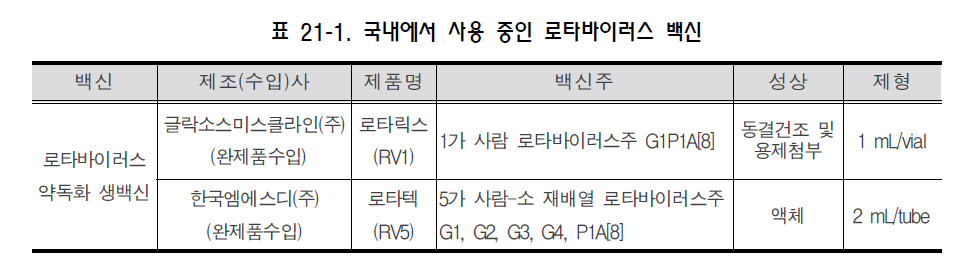 5가 백신(RotaTeq, 로타텍, RV5)은 경구용 생백신으로서 Merck사에서 제조하였으며, 우리나라 에서는 2007년 6월에 식품의약품안전청의 허가를 받았다. 이는 소와 사람에서 분리된 로타바이러스를 재편성하여 약독화한 것으로 5가 사람-소 로타바이러스 재편성 백신이다. 각 2 mL 바이알에는 각각의 5가지 재편성된 바이러스주(reassortant strains)를 포함하는 약 2 x 106 의 infectious units가 담겨있다. 백신 바이러스는 sucrose, sodium citrate, sodium phosphate monobasic monohydrate, sodium hydroxide, polysorbate 80 그리고 조직 배양액을 포함하는 버퍼액에 부유되어 있다. 이 백신에는 보존제나 티메로살은 포함되어 있지 않다. 제3상 임상시험에 참여한 사람들의 일부에서 백신 바이러스의 대변 배출여부를 평가하였다. 백신 바이러스는 첫 접종 후 360명의 영아 중 9%에서 발견되었으나 두 번째 접종을 받은 249명과 세 번째 접종을 받은 385명의 영아 중에서는 백신 바이러스가 발견되지 않았다. 백신 바이러스에 의한 전염의 가능성에 대해서는 평가하지 않았다. 1가 백신(Rotarix, 로타릭스, RV1)은 경구용 생백신으로서 글락소스미스클라인사에서 제조하였으며 우리나라에서는 2008년 3월에 식품의약품안전청의 허가를 받았다. 1가 백신은 사람바이러스주인 89-12(type G1P1a[8]) 한 주를 약독화한 것으로 만든 1가 사람 로타바이러스 백신이다. 1가 백신은 동결건조가루로 공급되며 투여 직전에 용액에 녹여 준다. 각 1 mL 용액 1회 접종량에는 배양된 바이러스 infectious unit으로 중앙값 약 106 이 포함되어 있다. 또한 백신에는 아미노산, dextran, Dulbecco's modified Eagle medium, sorbitol과 sucrose이 포함되어 있다. 희석제는 calcium carbonate, 물과 xanthan으로 이루어져 있고, 이 백신에는 보존제나 티메로살이 포함되어 있지 않다. 대변에 백신 항원의 배출 여부에 대한 조사가 여러 나라에서 시행되었다. 7개의 임상시험에 따르면, 첫 번째 접종 후 약 7일에 50~80%의 영아에서 바이러스가 ELISA로 검출이 되었으며 0~24%에서 약 30일에 검출되었다. 두 번째 접종 후에는 4~18%의 영아에서 약 7일에, 그리고 0~1.2%의 영아에서 약 30일에 바이러스가 검출되었다. 백신 바이러스에 의한 전염의 가능성에 대하여는 평가하지 않았다. (다) 면역원성 및 효과 5가 백신(로타텍)의 효능을 평가하는 제3상 임상시험은 11개국에서 시행된 것으로 6주에서 12주까지 연령의 영아 70,000명 이상이 참여한 연구들이었다. 계획된 세 번의 5가 백신을 접종한 후 모든 로타바이러스 위장관염에 대한 예방 효과는 74%이었고, 심한 로타바이러스 위장관염(발열, 구토, 설사 그리고 행동의 변화로 정의됨)에 대한 효과는 98%이었다. 백신 효능은 로타바이러스 혈청형에 따라 다양하였다. 한 대규모의 연구에서 생후 2년 동안 로타바이러스 위장관염으로 인한 개인의원 방문과 응급실 방문 및 입원에 대한 5가 백신의 효능을 각각 5,673명과 68,038명을 대상으로 평가하였다. 5가 백신은 로타바이러스에 위장관염에 의한 개인의원 방문을 86%, 응급실 방문을 94%, 그리고 입원을 96%까지 감소시켰다. 세 번의 접종보다 적은 횟수를 접종한 경우의 효능은 알려져 있지 않다. 1가 백신(로타릭스)의 효능에 대한 제3상 임상시험에서는 중남미와 유럽에서 시행된 두 개의 주된 연구들에 6주에서 12주의 연령의 영아 21,000명 이상이 포함되었다. 계획된 두 번의 1가 백신접종 후 심한 로타바이러스 위장관염에 대한 효능은 85%이었고(중남미 연구), 모든 로타바이러스 위장관염에 대한 효능은 87%이었다(유럽 연구). 연구에 따라 1가 백신은 로타바이러스 위장관염에 의한 입원을 85~100%까지 감소시켰다. 두 번의 접종보다 적은 횟수를 접종한 경우의 효능은 알려져 있지 않다. 로타바이러스 백신에 의한 면역 지속기간은 알려져 있지 않다. 두 백신 모두에서 두 번의 로타바이러스 시즌 동안 효능에 대한 연구가 되었으며, 일반적으로 첫 시즌보다 두 번째 시즌에서 효능이 낮다. 2) 실시기준 및 방법 (가) 접종대상 5가 백신은 생후 2, 4, 6개월, 1가 백신은 생후 2, 4개월로 금기사항이 없는 영아에게 특별한 이유가 없는 한 표준접종일정대로 접종한다. (나) 접종시기 및 방법 두 가지 로타바이러스 백신 중 어느 한 백신에 대한 선호는 없다. 로타바이러스 백신의 접종시기와 일정 및 연령에 대한 권고의 요약표는 다음과 같다(표 21-2). 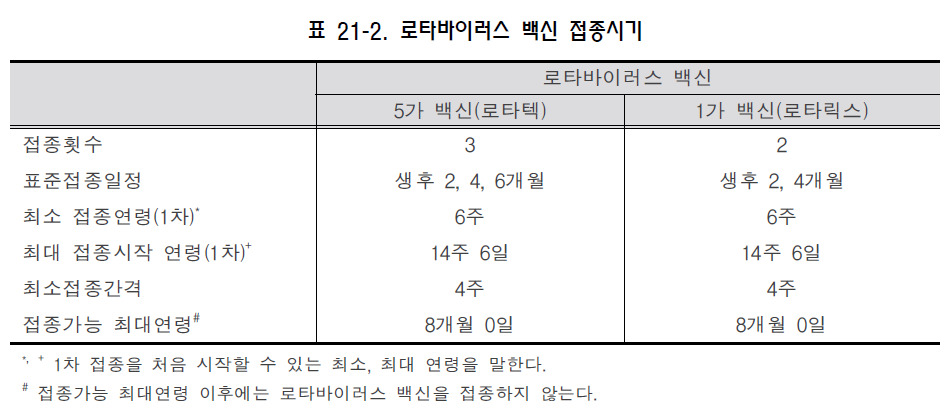 5가 백신은 세 번, 1가 백신은 두 번의 접종을 경구로 투여하며 생후 2개월에 시작하여야한다. 두 백신 모두 생후 6주에 시작해도 된다. 다음의 접종은 이전 접종과 1~2개월 간격을 두어야 한다. 우리나라에서 두 로타바이러스 백신을 맞을 수 있는 최대 연령은 8개월 0일로 권장하며 이를 초과하는 나이에서는 접종하지 않는다. 각 접종 간의 최장간격에 대한 정의는 없다. 추천되는 8주 간격을 지키는 것이 선호된다. 간격이 연장되어도 8개월 0일 이전까지의 영아에게는 남은 백신을 접종할 수 있다. 간격이 늘어났어도 접종을 추가하거나 처음부터 다시 시작할 필요는 없다. 3) 동시접종 및 교차접종 ◦ 동시접종 : 로타바이러스 백신은 DTaP, Hib, IPV, B형간염, 폐렴구균 백신과 동시접종이 가능하다. 인플루엔자 백신과의 동시접종에 대해서는 연구되지 않았으나 일반적으로 불활성화 백신과 약독화 생백신의 경우 동시접종이 가능하며 특별히 지켜야 할 접종간격이 없다. ◦ 교차접종 : 현재 1가 백신과 5가 백신의 교차접종에 관한 자료는 없다. 로타바이러스 백신의 경우 가능한 동일 제조사의 백신으로 접종하여야 한다. 하지만 이전에 사용한 백신 종류를 전혀 알 수 없거나, 백신 공급의 중단 등의 불가피한 사유 때문에 예방접종이 지연되어서는 안 된다. 이 경우 사용 가능한 백신을 이용하여 예방접종을 완료하며, 5가 백신이 한 번이라도 사용되었거나 이전에 접종한 백신을 알 수 없을 경우는 총 접종 횟수가 3회가 되도록 접종한다. (이 경우에도 생후 8개월 0일까지 완료함). 4) 금기사항 및 주의사항 (가) 금기사항 ◦ 백신 성분에 대한 심한 알레르기 반응이 있는 경우 ◦ 이전 접종 후 심한 알레르기 반응(아나필락시스)이 발생한 경우 ◦ 라텍스 알레르기 반응이 있는 경우(1가 백신은 구강 투여 기구에 라텍스 고무가 포함되어 있음. 5가 백신은 복용 기구에 라텍스가 함유되어 있지 않음) ◦ 중증복합면역결핍증 (나) 주의사항 다음과 같은 특수한 경우에 대한 주의사항이다. ◦ 1차 접종을 실수로 생후 15주 이후 접종한 경우 : 1차 접종의 시기가 이후 접종의 안전성 및 효과에 영향을 미치지 않으므로 로타바이러스 접종을 일정대로 생후 8개월 0일까지 완료한다. ◦ 로타바이러스 예방접종을 완료하기 전에 로타바이러스 장염이 걸린 경우 : 로타바이러스 장염을 앓았어도 로타바이러스에 대한 부분적인 면역만 형성될 수 있기 때문에 일정대로 예방접종을 완료한다. ◦ 미숙아에서의 접종 : 로타바이러스 접종에 의한 이득이 이론적인 위험보다 높다고 간주되므로 미숙아가 출생한 지 6주가 지났고 임상적으로 안정된 상태라면 신생아실에서 퇴원시 또는 그 후 접종이 가능하다. ◦ 면역기능저하 환자와 접촉하는 영아에 대한 접종 : 면역기능저하 환자와 같이 살고 있는 영아에게 로타바이러스 백신을 접종할 수 있다. 그러나 예방접종을 받은 영아에서 바이러스 배출이 가능하므로 전파를 최소화하기 위해 모든 가족들은 예방접종한 영아의 대변에 노출 시(예,기저귀 갈기) 손을 잘 씻도록 한다. ◦ 임신부와 접촉하는 영아에 대한 접종 : 임신부와 같이 살고 있는 영아에게 예방접종을 할수 있다. ◦ 백신을 구토한 경우 : 백신을 뱉거나 구토한 경우 재투여하지 않는다. ◦ 예방접종 후 입원 : 예방접종을 받은 영아가 입원한 경우, 일반주의(universal precaution) 지침에 따른다. ◦ 항체를 포함한 혈액제제를 투여 받거나 투여 받을 예정인 영아 : 항체를 포함한 혈액제제 투여 전‧후‧동시 어느 경우라도 백신을 권장되는 일정에 따라 접종한다. 이론적으로 면역반응이 낮을 수도 있으나 2회 또는 3회의 접종을 실시하면 적절한 항체생성이 될 수 있으므로 그대로 접종하도록 한다. ◦ 면역기능저하 환자 : 선천성 면역저하증, 조혈모세포 이식, 장기 이식 등으로 면역기능이 저하된 환자들은 간혹 심한, 장기간 또는 치명적인 로타바이러스 감염에 이환될 수 있다. 그러나 로타바이러스 백신을 이들 환자에게 투여 하였을 때의 안전성 및 유효성에 대한 자료가 부족하다. ◦ 급성 위장관염 및 기타 급성질환 : 일반적으로 로타바이러스 백신은 중등도 혹은 중증의 위장관염이나 기타 급성질환을 앓고 있는 영아에게는 투여하지 않으며, 상태가 호전된 후 투여한다. 그러나 가벼운 위장염이나 기타 경한 질환일 경우에는 접종할 수 있으며, 접종지연으로 첫 접종이 15주 0일 이후로 지연될 상황인 경우 특히 접종을 고려한다. ◦ 장겹침증을 앓은 병력이 있는 영아는 다른 영아에 비해 장겹침증이 반복적으로 발생할 위험이 높을 수 있으므로 추가적인 자료가 나올 때까지 장겹침증의 병력이 있는 영아에게 로타바이러스 백신 접종 시 위험과 이득을 고려한 결정을 내려야 한다. ◦ 기존의 만성 위장관 질환 ◦ 이분척추(spina bifida) 또는 방광외반증(bladder exstrophy)이 있는 영아는 라텍스 알레르기를 얻게 될 위험이 높은 군이므로 경구 투여기구에 라텍스가 포함되어 있지 않은 5가 로타바이러스 백신을 선호하는 전문가 의견도 있다. 그러나 1가 로타바이러스 백신만 구할 수 있는 상황에서는 1가 로타바이러스 백신을 접종한다. 5) 예방접종 후 이상반응 (가) 장겹침증 두 백신 모두 매우 규모가 큰 제3상 임상시험에서 일차적으로 백신 접종군과 위약 접종군에서 장겹침증이 발생하는 것을 연구할 수 있었다. 1가 백신 연구에서는 63,000명 이상의 영아가 참여하였고 절반은 백신을, 절반은 위약을 접종받았다. 백신과 위약 접종군에서 접종 후 30일내 발생한 장겹침증은 백신군에서 7건, 위약군 7건이었다. 5가 백신 연구에서는 69,000명 이상의 영아가 참여하였고 절반은 백신을, 절반은 위약을 접종받았다. 접종 후 42일 내에 백신군에서 장겹침증이 6건, 위약군에서는 5건이 발생하였다. 이 자료는 장겹침증 위약 접종군에서도 발생하였으므로 영아의 장겹침증 기본 발생률을 의미한다. 또한 로타바이러스 백신 접종자에서도 장겹침증은 발생할 수 있으나 그 위험도가 백신 미접종자에 비해 더 높지 않음을 시사한다. (나) 기타 이상반응 임상연구에서 여러가지 기타 이상반응이 로타바이러스 백신 접종 후 2일 또는 8일 동안 보고되었다. 구토 15~18%, 설사 9~24%, 보챔 13~62% 그리고 발열이 40~43%로 보고되었다. 그러나 백신 접종군에서 이들 증상은 비접종군에서의 발생과 비슷하였다. 로타바이러스 백신에 의한 심각한 중증 이상반응은 보고된 바 없다. 6) 백신 보관 및 관리 두 가지 모두 냉장고에서 2~8°C에 차광하여 보관한다. 1가 백신 희석액은 실온에 보관할 수 있다. 이 백신들은 얼리면 안된다. 보관 기간은 적절히 보관한 경우 24개월이다. 5가 백신은 냉장고에서 꺼낸 즉시 투여되어야 한다. 1가 백신은 희석액과 섞은 후 24시간 내에 투여하여야 하며 냉장고나 실온에 보관할 수 있다. 참 고 문 헌 1. 대한소아과학회. 예방접종지침서 제6판 로타바이러스, 서울, 광문출판사, 2008:1231-47. 2. Han TH, Kim CH, Chung JY, Park SH, Hwang ES. Genetic characterization of rotavirus in children in South Korea from 2007 to 2009. Arch Virol. 2010;155:1663-73. 3. Lee SY, Hong SK, Lee SG, Suh CI, Park SW, Lee JH, et al. Human rotavirus genotypes in hospitalized children, South Korea, April 2005 to March 2007. Vaccine. 2009;27 (Suppl 5):F97-101. 4. Seo JK, Sim JG. Overview of rotavirus infections in Korea. Pediatr Int. 2000;42:406-10. 5. Murphy TV, Gargiullo PM, Massoudi MS, et al. Intussusception among infants given an oral rotavirus vaccine. N Engl J Med 2001;344:564-72. 6. Parashar UD, Hummelman Eg, Bresee JS, et al. Global illness and deaths caused by rotavirus disease in children. Emerg Infect Dis 2003;9:565-72. 7. Vesikari T, Karvonen A, Prymula R, Schuster V, Tejedor JC, Cohen R, et al. Efficacy of human rotavirus vaccine against rotavirus gastroenteritis during the first 2 years of life in European infants: randomized, double-blind controlled study. Lancet 2007;370:1757-63. 8. Vesikari T, Mastson DO, Dennehy P, et al. Safety and efficacy of a pentavalent human-bovine (WC3) reassortant rotavirus vaccine. N Engl J Med 2006;354:23-33. 9. Widdowson MA, Steele D, Vojdani J, Wecker J, Parashar U. Global rotavirus surveillance: determining the need and measuring the impact of rotavirus vaccines.. J Infect Dis. 2009;200 Suppl 1:S1-8. 10. American Academy of Pediatrics. Rotavirus infections. In:Pickering LK, Baker CJ, Kimberlin DW, Long SS, eds. RedBook: 2009 Report of the Committee on Infectious Diseases. 28th ed. Elk Grove Village, IL, USA: American Academy of Pediatrics, 2009:576-9. 11. Centers for Disease Control and Prevention. General recommendations on immunization - Recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm Rep. 2011;28 (RR-2):60:1-64. 12. Centers for Disease Control and Prevention. Prevention of rotavirus gastroenteritis among infants and children. Recommendations of Advisory committee on Immunization Practices (ACIP). MMWR 2009 (RR-2);58:1-25.
|
|||
